
使用(yòng)校準微球技(jì )術的動脈栓塞技(jì )術(TAE)是影像引導微創治療發展史上非常成功的篇章。自從2000年代問世以來,具(jù)有(yǒu)均一粒徑和可(kě)預測形狀的栓塞顆粒能(néng)夠穿透更深,實現更末梢的栓塞。這些不同大小(xiǎo)的新(xīn)型顆粒可(kě)以被選擇用(yòng)于治療從前列腺增生到肝細胞癌(HCC)等全身各種疾病。校準微球可(kě)以在一個高度選擇的靶血管内機械性阻塞血液流動。目前正在嘗試利用(yòng)這種精(jīng)确性來更準确地輸送新(xīn)型治療藥物(wù),并開發生物(wù)可(kě)降解的栓塞顆粒。這種通用(yòng)性使這些設備功能(néng)強大,因為(wèi)其靈活的設計适用(yòng)于無數的臨床場景,例如提高實體(tǐ)腫瘤對免疫治療的臨床反應。本文(wén)綜述了目前最常用(yòng)的微球産(chǎn)品及其應用(yòng)。
機械性能(néng)及局限性
微球技(jì )術的改進使經導管介入治療的臨床應用(yòng)日益擴大。早期栓塞材料,包括自體(tǐ)血凝塊、彈簧圈和明膠海綿,被證明有(yǒu)助于治療急性出血。然而,當需要更末梢栓塞時,它們缺乏必要的改進。此外,由于它們不可(kě)預測的大小(xiǎo)和形狀,非靶向栓塞的風險很(hěn)高。氣體(tǐ)交換發生在末梢微血管中(zhōng),這裏的小(xiǎo)動脈和毛細血管的直徑為(wèi)10 - 30 μm。即使采用(yòng)最佳的栓塞技(jì )術,也常常導緻更近端血管(直徑為(wèi)> 40 µm)的阻塞。鑒于近端栓塞的特性,組織灌注将通過側枝循環和新(xīn)的灌注血管持續存在。Johnson等人在兔腫瘤模型中(zhōng)量化了這種殘餘灌注。用(yòng)100 - 300 μm的微球栓塞腫瘤至血流停滞,僅使56%的腫瘤微血管血流停止。栓塞至停滞和接近停滞之間的主要區(qū)别在于新(xīn)的灌注微血管的出現,而這在栓塞至血流停滞的腫瘤中(zhōng)幾乎不存在。我們最近的研究通過評估不同大小(xiǎo)的微球 (40-60 µm vs 70-150 µm) 栓塞後腫瘤微血管的缺氧程度,證實了這些發現。較小(xiǎo)的微球能(néng)更深地穿透入腫瘤血管,減少了側枝殘餘灌注的可(kě)能(néng)性,從而導緻更嚴重的壞死。當使用(yòng)太大的微球栓塞靶血管時,殘餘灌注使缺氧的腫瘤細胞得以存活。因此,開發出校準的栓塞顆粒是必要的,并且其适應各種血管和内髒介入的栓塞,包括藥物(wù)輸送和内放射治療。
栓塞顆粒的進展
自1970年代以來, PVA顆粒作(zuò)為(wèi)一種可(kě)靠且經濟的栓塞劑被用(yòng)于栓塞治療并迅速得到廣泛應用(yòng)。PVA是可(kě)壓縮的,但在導管輸送後會恢複形狀。早期PVA産(chǎn)品的粒徑分(fēn)布不均勻,粒徑範圍為(wèi)100 - 1100 µm,其後這種栓塞劑被改良成較小(xiǎo)的、校準的PVA (Contour,Boston Scientific Corporation)。
栓塞顆粒的另一個突破是三丙烯明膠微球(TAGM) (Embosphere, Merit Medical Systems)。Embospheres是帶有(yǒu)明膠塗層的丙烯酰胺單體(tǐ)的聚合物(wù)。這些緊密校準的微球攜帶陽離子,使得它們具(jù)有(yǒu)親水性和抗聚集性。通常,這些顆粒在注射前懸浮在造影劑和生理(lǐ)鹽水中(zhōng),并提供40 - 1200 µm的校準尺寸。與TAGM相比,在子宮動脈栓塞(UAE)臨床前模型中(zhōng),不均勻PVA顆粒的近端和遠(yuǎn)端聚集率更高。使用(yòng)相應尺寸的球形PVA顆粒可(kě)獲得類似的即刻技(jì )術成功率,但在術後3個月的影像中(zhōng)顯示出明顯更高的不完全緩解率。與TAGM相比,PVA的高度可(kě)壓縮性可(kě)能(néng)導緻顆粒的形态變化和非靶向再分(fēn)布,從而導緻反應率欠佳。
Bead Block(Boston Scientific Corporation)代表了PVA顆粒的另一個進步。它們是由生物(wù)相容的PVA水凝膠與丙烯酸聚合物(wù)交聯組成的校準微球。Bead Block具(jù)有(yǒu)獨特的吸濕性,水分(fēn)子散布其間,導緻堵管和顆粒聚集發生率較低。然而,它們的吸濕性通常需要較長(cháng)的準備時間。Embozene微球(Varian Medical)是另一種高度校準的微球,由不可(kě)吸收的外覆Polyzene-F聚合物(wù)的水凝膠制成,有(yǒu)40 - 1300 µm等多(duō)種尺寸。
藥物(wù)洗脫微球技(jì )術的發展徹底改變了經導管栓塞技(jì )術。有(yǒu)幾種可(kě)用(yòng)的設備,包括含有(yǒu)磺酸基團的PVA微球(DC Bead, Boston Scientific Corporation),含有(yǒu)丙烯酸鈉基團的微球(HepaSpheres, Merit Medical Systems),以及藥物(wù)洗脫版的Embozene (Oncozene, Varian Medical)。DC Beads是PVA與2-丙烯酰胺-2-甲基丙烷磺酸鹽的共聚物(wù),可(kě)以通過離子交換與低分(fēn)子量且帶正電(diàn)荷的藥物(wù)結合。類似地,HepaSpheres利用(yòng)醋酸乙烯酯和丙烯酸甲酯單體(tǐ)的聚合作(zuò)用(yòng)來結合化療藥物(wù)。這些藥物(wù)洗脫微球(DEBs)可(kě)以加載和釋放伊立替康和多(duō)柔比星,而這些藥物(wù)主要用(yòng)于肝腫瘤的TACE治療(圖1)。

圖1. 微球技(jì )術曆史和發展示意圖。左圖:顆粒材料的改良和直徑縮小(xiǎo),以實現更精(jīng)準更末梢的栓塞。從自體(tǐ)血凝塊、不鏽鋼球、明膠海綿進化為(wèi)各種材料和直徑的校準微球,以适應更複雜的治療類别,并改善藥物(wù)釋放特性。右圖:不斷擴大的以導管為(wèi)基礎的介入治療與免疫治療相結合,以克服免疫抑制腫瘤微環境的挑戰。順時針方向:聯合治療中(zhōng),血管外的微球激活了T細胞并激發腫瘤,增強了細胞毒性反應,激活了Toll樣受體(tǐ),同時免疫檢查點抑制激活了自然殺傷細胞。
微球技(jì )術用(yòng)于良性疾病的最新(xīn)進展
校準微球技(jì )術固有(yǒu)的靈活性特别适合于良性疾病的栓塞,這些疾病的栓塞靶血管是特定的血管叢。最佳的子宮肌瘤栓塞技(jì )術需要栓塞直徑為(wèi)500-800 μm的肌瘤周圍血管叢。較小(xiǎo)的校準顆粒(< 500 μm)可(kě)越過血管叢,滞留在較細的小(xiǎo)動脈中(zhōng),這可(kě)能(néng)導緻子宮肌層梗死。因此,通常首選500-700 µm或700-900 μm的不可(kě)吸收微球。成功治療需要使用(yòng)精(jīng)确直徑範圍的栓塞顆粒,這使得FDA批準了幾種用(yòng)于UFE的栓塞顆粒,包括PVA和TAGM。校準微球提供了精(jīng)确的栓塞水平,導緻不同的栓塞終點模式。使用(yòng)微球栓塞後,子宮動脈内的血流減慢足以證明栓塞劑充分(fēn)穿透到肌瘤周圍血管叢,而非校準的栓塞顆粒則通常以造影劑停滞作(zuò)為(wèi)栓塞終點。由于存在術後卵巢功能(néng)永久性降低的很(hěn)小(xiǎo)風險,人們對開發一種用(yòng)于UAE的臨時性栓塞劑重新(xīn)産(chǎn)生了興趣。Hacking等人使用(yòng)新(xīn)型的、700-1000 μm的生物(wù)可(kě)吸收凝膠微球連續對23名(míng)患者進行了UFE,栓塞終點為(wèi)完全停滞。術後3個月MRI顯示,83%的患者100%的肌瘤梗死,這一比率與使用(yòng)永久性栓塞劑進行的栓塞相當。其他(tā)幾種臨時性栓塞微球目前正在進行各種臨床前研究。
校準微球對于前列腺動脈栓塞(PAE)也具(jù)有(yǒu)獨特的優勢。UK-ROPE研究顯示,較小(xiǎo)的Embozene微球(< 400 µm) 和100-200 µm的非球形PVA的PAE術後的臨床結果相似。Bilhim等人也報道了類似的結果,他(tā)們使用(yòng)300-500 μm 的Bead Block和100-300 μm的非球形PVA顆粒,PAE術後2年的技(jì )術和臨床成功率相當。另一項單中(zhōng)心随機臨床試驗顯示,使用(yòng)100-300 µm和300-500 µm Embosphere進行PAE的結果沒有(yǒu)顯著差異。小(xiǎo)粒徑組與大粒徑組在輕度不良事件(如排尿困難、尿頻、血尿)方面有(yǒu)顯著差異(86% vs 41%)。兩組均無嚴重不良事件的記錄。Wang等人證實,與單獨使用(yòng)100 µm PVA顆粒相比,聯合使用(yòng)50 µm和100 µm PVA顆粒進行PAE後,臨床和影像學(xué)結果得到改善。Bagla等人也報道了在PAE治療良性前列腺增生患者時使用(yòng)Embozene具(jù)有(yǒu)類似的有(yǒu)效性和安(ān)全性。進一步的前瞻性多(duō)中(zhōng)心研究正在進行中(zhōng),以确定PAE的最佳栓塞劑。
腫瘤微環境的新(xīn)概念
最新(xīn)的研究對肝腫瘤栓塞後的微環境進行了更詳細的描述。因腫瘤供血動脈突然閉塞而導緻的缺氧損傷的程度是治療結果的關鍵決定因素。當缺血和藥物(wù)毒性聯合仍不足以殺滅整個目标腫瘤時,存活下來但處于應激狀态的癌細胞可(kě)以通過激活細胞遷移、血管生成和轉移等相關的生存途徑來适應缺氧和營養匮乏的環境。我們的臨床前研究表明,在肝動脈栓塞(HAE)和DEB-TACE治療後3天,存活腫瘤細胞的缺氧應激增加,7天後下降。所有(yǒu)治療臂的腫瘤缺氧反應證明微球的大小(xiǎo)對存活腫瘤細胞的缺氧應激有(yǒu)顯著影響,我們觀察到,相比于40-60 μm微球治療組,70-150 µm微球治療組中(zhōng)的大鼠有(yǒu)更高程度的殘餘腫瘤缺氧應激。
傳統上,研究HAE對肝實質(zhì)影響的實驗主要聚焦于HCC患者的循環外周細胞。這些研究分(fēn)析了TACE前、後的循環免疫細胞亞群,包括CD4+細胞(Th1、Th17和Treg細胞)、CD8+ T細胞、NK細胞和NKT細胞,以及血漿細胞因子,發現TACE後1個月循環Th17細胞的出現頻率顯著增加。此外,在大鼠HCC模型中(zhōng),經空白TAE後,Th17細胞的全身和肝髒募集以及它們的标志(zhì)性細胞因子白細胞介素-17A的表達增加,在促炎症微環境中(zhōng)發揮了核心作(zuò)用(yòng)。最近的研究着重于HCC中(zhōng)使用(yòng)TAGM微球栓塞後的免疫反應,研究表明,治療後腫瘤中(zhōng)含有(yǒu)明顯更多(duō)的CD3、CD4和CD8腫瘤浸潤淋巴細胞,而微球位于血管外對于誘發更強的免疫反應至關重要。這些發現确證了我們最近觀察到的結果,即栓塞治療後腫瘤内CD8和FOXP3 T細胞增加,以及瘤周巨噬細胞數量增加(圖2)。
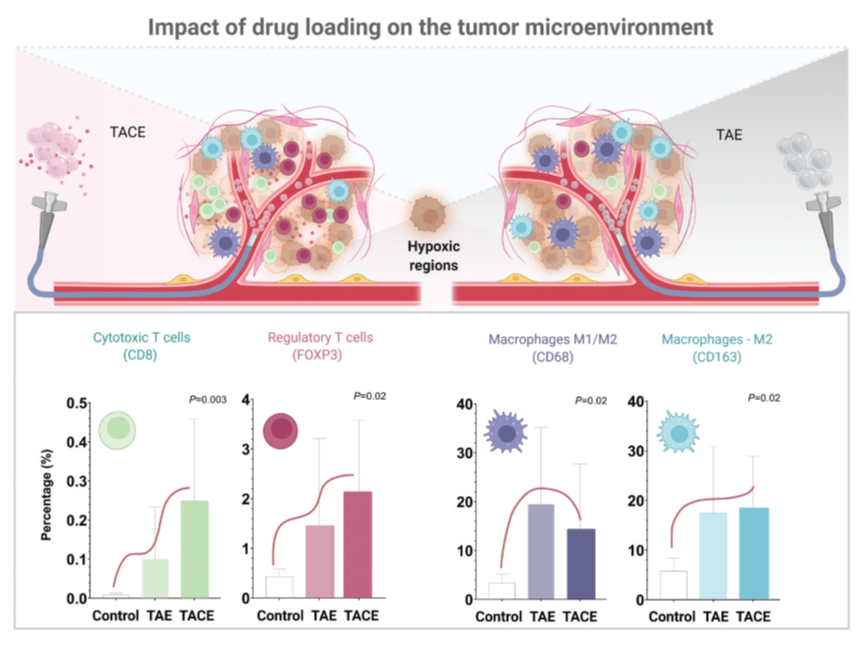
圖2。使用(yòng)未加載或加載鹽酸多(duō)柔比星的含磺酸基團的PVA微球行TAE後腫瘤微環境的不同反應。上圖:不同栓塞方式治療後的腫瘤微環境反應示意圖。下圖:在多(duō)柔比星洗脫微球治療的腫瘤中(zhōng)觀察到細胞毒和FOXP3表達T細胞(CD8+,Tregs)有(yǒu)更高的浸潤 (左)。與生理(lǐ)鹽水對照組相比,觀察到微球治療組有(yǒu)明顯的腫瘤巨噬細胞向M2狀态極化的趨勢。然而,在随訪期間(術後14天),DEB組和空白微球組之間未觀察到明顯的差異趨勢(右)。
肝癌的研究進展
經導管肝動脈化療栓塞術仍然是中(zhōng)晚期HCC患者微創治療的中(zhōng)流砥柱,也常用(yòng)于治療神經内分(fēn)泌癌腫瘤和結腸癌的肝轉移。對cTACE中(zhōng)化療藥物(wù)所引起的全身毒性的擔憂導緻了DEB-TACE的出現。這種方法有(yǒu)力結合了血管閉塞引起的缺血與藥物(wù)輸送。用(yòng)于TAE和TACE的典型微球粒徑為(wèi)100 - 300 μm。豐富的肝側支循環為(wèi)徹底閉塞肝腫瘤血管帶來了挑戰,也使得栓塞後腫瘤内缺氧的嚴重程度難以預測。與血管栓塞後的缺血應激不同,DEB-TACE後多(duō)柔比星對腫瘤的影響不是即刻的,因為(wèi)藥物(wù)會洗脫進入周圍組織。Gaba等人證實,提高微球加載多(duō)柔比星的濃度會導緻兔VX2腫瘤更明顯的壞死。這些結果強調,在微球附近的多(duō)柔比星會在栓塞後缺氧腫瘤微環境和免疫背景方面影響存活的應激癌細胞,這使聯合應用(yòng)新(xīn)型免疫調節劑的策略成為(wèi)可(kě)能(néng)。
免疫療法的興起使晚期疾病患者産(chǎn)生了持久的反應,從而改變了腫瘤學(xué)領域。該療法通過重置共刺激信号和之間的平衡起效,免疫檢查點可(kě)以調節腫瘤免疫微環境中(zhōng)細胞毒T細胞的活性和反應強度。但很(hěn)多(duō)患者并沒有(yǒu)從這些新(xīn)療法中(zhōng)完全受益。對免疫治療的充分(fēn)反應有(yǒu)幾個衆所周知的障礙,包括腫瘤抗原的低免疫原性、抗原耐受、浸潤性細胞毒T細胞數量有(yǒu)限、以及免疫抑制的腫瘤微環境。
傳統TAE後完全動脈阻塞造成的缺氧似乎創造了一個免疫抑制的腫瘤微環境。初始栓塞後存活的受損缺氧腫瘤細胞是治療結果的主要決定因素,這些存活的腫瘤細胞通常表現出更強的侵襲性。另一個重要的考慮是,在最初的栓塞損傷中(zhōng)存活下來的細胞群可(kě)能(néng)會進入靜止狀态,這再次為(wèi)它們提供了保護,以抵抗針對細胞周期的細胞毒性藥物(wù)。DEB-TACE和免疫療法的結合可(kě)以克服這些挑戰。研究已經證實了聯合應用(yòng)肝髒局部治療和免疫檢查點抑制劑的安(ān)全性和耐受性。Wu等通過回顧性研究評估了侖伐替尼與抗PD-1免疫治療聯合TACE的安(ān)全性和有(yǒu)效性,取得了較高的腫瘤反應率(77.4%),優于既往觀察到的血管内皮生長(cháng)因子抑制劑與抗PD-L1抗體(tǐ)聯合全身治療的反應率。DEBs在輸送其他(tā)免疫調節劑和激活關鍵的免疫刺激途徑方面具(jù)有(yǒu)巨大的潛力,同時還降低了全身毒性。DEBs可(kě)用(yòng)于輸送Toll樣受體(tǐ)激動劑,這是很(hěn)有(yǒu)前景的一類藥物(wù),它們可(kě)能(néng)引發抗腫瘤反應,而靜脈内給藥與不可(kě)接受的全身毒性有(yǒu)關。作(zuò)者已經成功地将這些新(xīn)型藥物(wù)加載在微球上進行局部輸送,表現出良好的釋放特性。
結論
為(wèi)了提高栓塞效果,需要熟悉不同微球的機械性能(néng)及其對組織微環境的影響。最近的研究已經确定了微球的直徑、藥物(wù)加載和位置對栓塞後炎症環境的作(zuò)用(yòng)。對細胞水平變化的細化将使影像引導的微創介入治療與免疫治療相結合成為(wèi)可(kě)能(néng)。
 企業郵箱Enterprise email
企業郵箱Enterprise email
官方微信
17318979593
添加QQ
3010152399
聯系電(diàn)話
028-85027872